Genómica: conocimiento
Explorar el eje intestino-cerebro
Explorar el eje intestino-cerebro: ¿cómo se comunican las bacterias del intestino con el cerebro?
Hipócrates, hace más de 2,000 años, atribuyó el origen de las enfermedades al sistema gastrointestinal[1]. Si bien estas ideas sin duda se adelantaron a su tiempo, los científicos ahora se dan cuenta de cuán precisas pueden ser estas declaraciones. Se cree que el microbioma intestinal, o la colección de microbios que habitan en nuestro tracto gastrointestinal, desempeñan un papel esencial en el funcionamiento diario del cuerpo humano. Si bien los científicos están aprendiendo más sobre las asociaciones de microbios gastrointestinales alterados con la salud y la enfermedad, apenas estamos comenzando a descubrir los mecanismos y vías subyacentes a estas conexiones. Con la aparición y mejora de la tecnología de secuenciación genómica en los años recientes, el estudio del microbioma se ha vuelto más accesible y asequible. Este mayor acceso ha permitido la creación de esfuerzos científicos a gran escala para caracterizar qué microbios habitan en qué áreas del cuerpo humano, un esfuerzo conocido como mapeo del microbioma humano, como el Proyecto del Microbioma Humano, financiado por los Institutos Nacionales de Salud[2, 3]. Dados estos avances en el mapeo del microbioma humano, existe un interés creciente en investigar cómo el microbioma está conectado con el cerebro.
Descripción general del microbioma y el eje intestino-cerebro
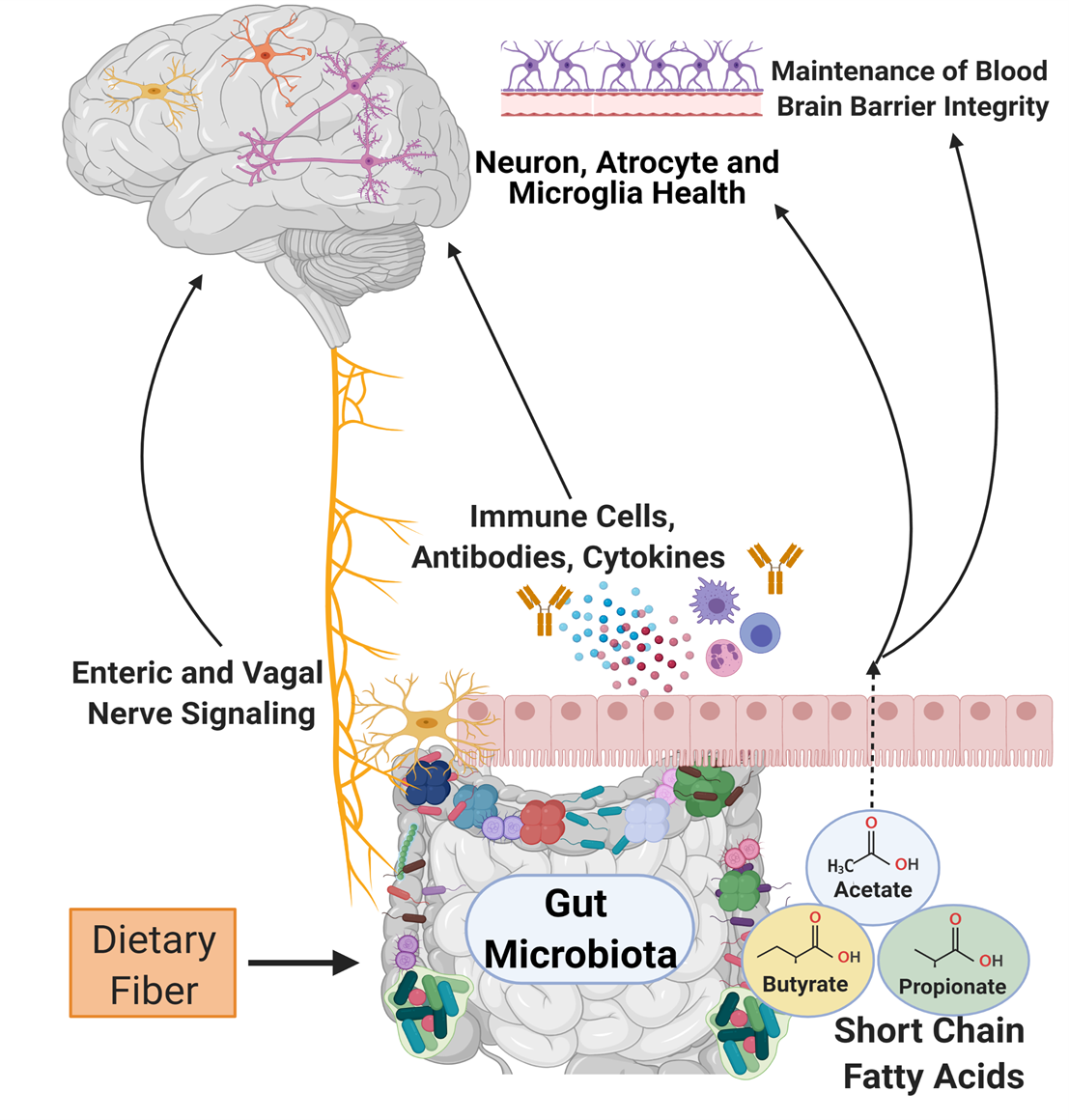
Las bacterias de la microbiota humana son microorganismos comensales, definidos como organismos que viven juntos y se benefician unos de otros, que colonizan múltiples superficies y nichos del cuerpo, incluido el tracto gastrointestinal. Estas bacterias gastrointestinales realizan funciones fisiológicas vitales desde el metabolismo de los nutrientes hasta la liberación de neurotransmisores (>95 % de la serotonina en el cuerpo, una hormona fundamental que estabiliza nuestro estado de ánimo, se produce en el tracto gastrointestinal)[4]. Recientemente, los científicos han estado publicando investigaciones que muestran que la influencia de la microbiota gastrointestinal no se limita solo al tracto gastrointestinal; estas bacterias también desempeñan un papel destacado en la comunicación bidireccional entre el tracto gastrointestinal y el cerebro (denominado eje intestino-cerebro). Ciertos cambios dañinos en las bacterias del microbioma gastrointestinal están asociados con trastornos neurológicos y de salud mental, como ansiedad, autismo, depresión, Parkinson y enfermedad de Alzheimer[5]. Estas asociaciones son emocionantes, ya que abren caminos para comprender y tratar trastornos cerebrales mediante el estudio y el cambio de la microbiota gastrointestinal. Actualmente, tenemos un conocimiento básico de tres rutas a través de las cuales la microbiota intestinal puede comunicarse con el cerebro: señalización de metabolitos, el sistema inmunitario y el sistema nervioso.
(...) la influencia de la microbiota intestinal no se limita al tracto gastrointestinal, sino que estas bacterias desempeñan un papel importante en la señalización bidireccional entre el intestino y el cerebro (...).
Señalización de metabolitos
A medida que avanza la tecnología del análisis de microbiomas, los científicos pueden clasificar las especies de bacterias y comprender qué procesos metabólicos aumentan o disminuyen cuando hay cambios en el entorno microbiano. Estos datos pueden ayudarnos a comprender la influencia que pueden tener las alteraciones del microbioma en los procesos fisiológicos fuera del tracto gastrointestinal. Los metabolitos producidos por la microbiota intestinal que han sido los más investigados son los ácidos grasos de cadena corta. Las bacterias de la microbiota intestinal producen ácidos grasos de cadena corta (es decir, butirato, acetato y propionato), a través del proceso de descomposición de carbohidratos complejos. Están involucrados con funciones corporales esenciales del intestino y entre múltiples sistemas corporales, incluido el cerebro. Por ejemplo, los ácidos grasos de cadena corta están implicados en la maduración y el desarrollo de las células defensoras del huésped en el cerebro (microglía), a través de su regulación de la señalización del receptor de ácidos grasos libres 2 (free fatty acid receptor 2, FFAR2)[6]. Los ácidos grasos de cadena corta también están asociados con una mejor protección del cerebro, a través de la barrera hematoencefálica. La barrera hematoencefálica es la primera línea de defensa contra la invasión de grandes moléculas y patógenos. Si el cuerpo no tiene suficientes ácidos grasos de cadena corta disponibles, hay una descomposición de proteínas que refuerzan el sistema de defensa de la barrera hematoencefálica[6].
Sistema inmunitario
Las células inmunitarias de inmunoglobulina A (IgA) están diseñadas para proteger al cuerpo de infecciones virales y bacterianas. Como parte del eje intestino-cerebro, las células inmunitarias IgA son entrenadas por las bacterias de la microbiota intestinal para preservar la barrera hematoencefálica. Las células productoras de anticuerpos IgA habitan y defienden la barrera hematoencefálica que rodea el sistema nervioso central para evitar que el cerebro sea susceptible a infecciones. La notable importancia de estas células IgA entrenadas microbianamente se demostró cuando la eliminación de las células IgA resultó en una mayor incidencia de infecciones cerebrales mortales en ratones[7]. En otras palabras, los ratones que recibieron antibióticos que agotaron estas células IgA en su cuerpo tuvieron una capacidad sustancialmente menor para combatir infecciones. En los seres humanos, una mayor susceptibilidad a la inflamación e infección del cerebro puede aumentar el riesgo de sufrir trastornos neurológicos, como la enfermedad de Alzheimer y demencia[8]. La IgA no es la única célula inmunitaria que desempeña un papel en el eje intestino-cerebro, pero es un aparente guardián contra las infecciones y la inflamación posterior.
Sistema nervioso
El sistema nervioso entérico, el subconjunto del sistema nervioso que controla partes del tracto gastrointestinal[9], y el nervio vago son componentes esenciales del sistema de transmisión de información bidireccional del eje intestino-cerebro. El nervio vago, también conocido como par craneal X y el principal nervio parasimpático del cuerpo, ayuda a aliviar el estrés; se origina en el tronco del encéfalo y se extiende al sistema gastrointestinal. Las bacterias gastrointestinales interactúan y envían señales al nervio vago para facilitar la comunicación y los efectos en el cerebro y la médula espinal[10].
Se ha demostrado que cepas bacterianas específicas, como Campylobacter jejuni o Lactobacillus rhamnosus (JB-1), activan o reducen la expresión en regiones específicas del cerebro (hipotálamo paraventricular, amígdala y corteza cingulada, entre otras) en ratones a través de la comunicación con el nervio vago[11, 12]. La expresión en estas regiones del cerebro es vital para la regulación del estado de ánimo y del sistema nervioso, y la activación anormal puede estar relacionada con un mayor riesgo de sufrir trastornos que van desde depresión hasta enfermedades cardiovasculares en los seres humanos[12, 13]. Esta es un área de investigación abierta para probar y replicar el conocimiento traslacional entre modelos animales y humanos.
El sistema nervioso entérico humano contiene aproximadamente entre 200 y 600 millones de neuronas y se ha descrito como el "segundo cerebro" del cuerpo[14]. Los nervios del sistema nervioso entérico interactúan directamente con las bacterias de la microbiota gastrointestinal[15]. Los metabolitos bacterianos, como los ácidos grasos de cadena corta, pueden influir en el sistema nervioso entérico, lo que demuestra que el eje intestino-cerebro es un sistema interconectado y bastante complejo[16].
Conclusión
En general, las investigadoras todavía están explorando los mecanismos a través de los cuales las bacterias de la microbiota gastrointestinal pueden enviar señales al cerebro. Los esfuerzos de investigación futuros enfocados en metodologías traslacionales están abriendo nuevas oportunidades para el conocimiento. Esta información aumentará la comprensión de cómo se puede modular la microbiota para influir, y posiblemente reducir, la susceptibilidad de enfermedades a los trastornos neuropsiquiátricos y mejorar la salud humana.
Nota de las autoras: El contenido es responsabilidad exclusiva de las autoras y no necesariamente representa las opiniones oficiales de los Institutos Nacionales de Salud. Figuras creadas con Biorender.
Acerca del autor
Caitlin Dreisbach es investigadora posdoctoral de la Universidad de Columbia. Su investigación utiliza técnicas científicas de datos para descubrir las complejidades biológicas y experimentales de la salud materna durante el embarazo.
Katherine y Caitlin son miembros de la Sociedad Internacional de Enfermeros en Genética (International Society of Nurses in Genetics, ISONG) y les apasiona incorporar metodologías y técnicas genómicas en la investigación y la educación en enfermería.