Genómica: conocimiento
Investigación de la farmacogenómica sobre efectos adversos
Introducción
La farmacogenómica es el estudio de cómo los genes de una persona afectan su respuesta a los medicamentos. Los expertos utilizan la farmacogenómica para elaborar medicamentos que sean seguros y eficaces, así como dosis personalizadas para la composición genética de cada persona. Este campo de investigación forma parte de la medicina de precisión con la meta a largo plazo de tratar a los pacientes de forma individual según sus genes. La mayoría de los medicamentos disponibles están hechos para que los usen todas las personas, pero en muchos casos estos medicamentos no se ajustan a las necesidades de cada uno porque pueden tener efectos adversos graves, a los que también se conoce como efectos secundarios. Para que la terapéutica sea más accesible a una mayor población, un área que debería explorarse es el control mediante la genotipificación y la identificación de variantes genéticas de los efectos adversos de los medicamentos utilizados para los trastornos mentales, como los antidepresivos. Esto permitirá a los investigadores determinar aquellas variantes genéticas asociadas con efectos secundarios adversos y aquellas variantes que no tienen ningún impacto.
Este campo de investigación forma parte de la medicina de precisión con la meta a largo plazo de tratar a los pacientes de forma individual según sus genes.
La genotipificación es el proceso de determinar los diferentes polimorfismos de un solo nucleótido (single nucleotide polymorphisms, SNP) mediante el examen de la secuencia de ADN de una persona. Los SNP son errores de deletreo en una secuencia de ADN de los nucleótidos adenina, guanina, citosina y timina. Los SNP pueden actuar como marcadores biológicos, que son indicadores de una determinada enfermedad o efecto adverso. Si la genotipificación se utiliza como protocolo de detección, los médicos podrían recetar medicamentos a personas que no tengan esas variantes específicas asociadas con efectos adversos.
Miller et. al (2019) afirman que dos genes, el citocromo P450 2D6 (CYP2D6) y el citocromo P450 2C19 (CYP2C19), podrían ser objeto de ensayos clínicos a fin de reducir los efectos adversos graves de los medicamentos utilizados para tratar trastornos mentales. Los medicamentos son antidepresivos tricíclicos (Tricyclic Antidepressants, TCA) y tienen una estructura que contiene aminas terciarias y secundarias. CYP2D6 metaboliza las aminas terciarias y secundarias, mientras que CYP2C19 solo metaboliza las aminas terciarias (ver figura 1). Los TCA son un tipo de antidepresivo llamado inhibidores de la recaptación de serotonina (Serotonin Reuptake Inhibitors, SSRI) e inhiben las enzimas CYP2D6 y CYP2C19, lo que aumenta los efectos secundarios adversos. La inhibición de los genes CYP2D6 y CYP2C19 puede afectar la capacidad de la enzima para metabolizar medicamentos. Si el cuerpo tiene un metabolismo deficiente, los efectos adversos serán más graves.
Si la genotipificación se utiliza como protocolo de detección, los médicos podrían recetar medicamentos a personas que no tengan esas variantes específicas asociadas con efectos adversos.
Métodos
A. Recomendaciones de dosificación con base en la puntuación del metabolismo funcional
La puntuación del metabolismo funcional es una herramienta en la que se han centrado los investigadores para hacer recomendaciones sobre la dosificación de los medicamentos. En un estudio, los científicos recolectaron ADN de pacientes y analizaron sus genes mediante la genotipificación (Hicks et al., 2016). Los investigadores probaron los SNP en los alelos CYP2D6 y CYP2C19. Se desarrolló un sistema de puntuación para determinar el estado funcional de los alelos. Para el alelo CYP2D6, una puntuación de 2 o superior representaba una metabolización ultrarrápida, una puntuación de 1 representaba una función normal, una puntuación de 0.5 representaba una función disminuida y una puntuación de 0 representaba una función nula. Los pacientes con dos alelos CYP2C19 normales se consideraron metabolizadores normales. Los pacientes con uno o dos alelos CYP2C19 que no funcionaban se consideraron metabolizadores intermedios o deficientes
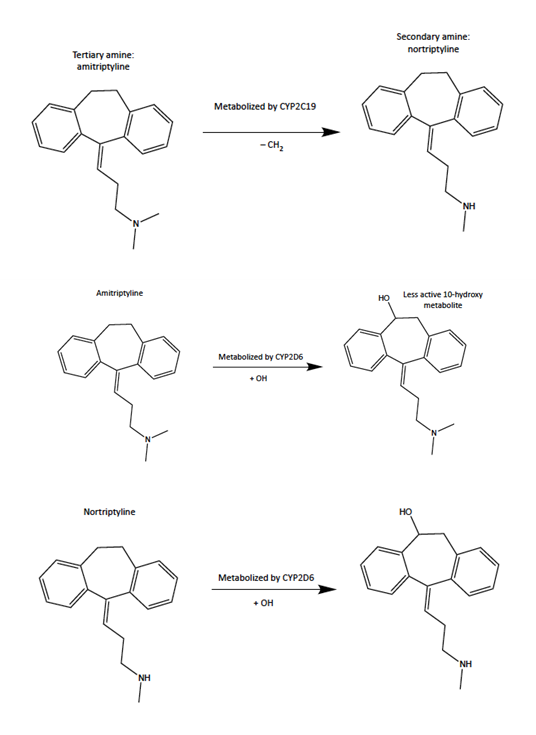 Figura 1: CYP2D6 y CYP2C19 son las enzimas de la familia de genes del citocromo P450. CYP2C19 solo metaboliza la amitriptilina (amina terciaria) que se convierte en norttriptilina (amina secundaria). CYP2D6 metaboliza la amitriptilina, que se convierte en un metabolito menos activo de la nortriptilina. CYP2D6 luego metaboliza la nortriptilina.
Figura 1: CYP2D6 y CYP2C19 son las enzimas de la familia de genes del citocromo P450. CYP2C19 solo metaboliza la amitriptilina (amina terciaria) que se convierte en norttriptilina (amina secundaria). CYP2D6 metaboliza la amitriptilina, que se convierte en un metabolito menos activo de la nortriptilina. CYP2D6 luego metaboliza la nortriptilina.B. Recomendaciones de dosificación con base en los resultados de la prueba NeuroIDgenetix
Otra herramienta que los investigadores han explorado para hacer recomendaciones de dosificación es la prueba NeuroDgenetix. El propósito de este estudio fue evaluar la efectividad de la medicina guiada por farmacogenética. Un estudio realizado en 20 centros clínicos de EE. UU. seleccionó aleatoriamente a 685 pacientes según la enfermedad y su gravedad y los asignó al grupo experimental (prueba NeuroIDgenetix) o al grupo de control (tratamiento estándar). "El NeuroIDgenetix usa un panel de variantes genéticas de diez genes junto con medicamentos concomitantes para hacer recomendaciones en el manejo de los medicamentos con base en las interacciones gen-medicamentos y medicamento-medicamento para más de 40 medicamentos usados en el tratamiento de la depresión y la ansiedad" (Bradley et. al, 2017). Se recolectaron muestras de todos los pacientes utilizando hisopos bucales. Se probaron variantes farmacodinámicas y farmacocinéticas asociadas con CYP2C19, CYP2D6. Los resultados de la prueba NeuroIDgenetix del grupo experimental se entregaron a los médicos participantes. Al grupo de control también se le administró la prueba NeuroIDgenetix, pero sus resultados fueron retenidos. Los resultados del grupo experimental se entregaron a los médicos con dos semanas de anticipación para que pudieran realizar cambios en los medicamentos. Se evaluó a los pacientes en busca de síntomas de ansiedad por depresión utilizando la Escala de Calificación de Hamilton para la Ansiedad (Hamilton Rating Scale for Anxiety, HAM-A) y la Escala de Calificación de Hamilton para la Depresión (Hamilton Rating Scale for Depression, HAM-D17). HAM-D17 y HAM-A son cuestionarios que se utilizan para reconocer cualquier indicio de depresión o ansiedad en los pacientes y se utilizan para evaluar la recuperación. Las evaluaciones se realizaron al inicio del estudio y en intervalos de las 4.º, 8.º y 12.º semanas. Tanto los médicos como los pacientes supervisaron los efectos adversos de los medicamentos.
Resultados
A. Recomendaciones de dosificación con base en la puntuación del metabolismo funcional
Con base en los resultados de las pruebas genéticas de CYP2D6 y CYP2C19, los investigadores han creado la Guía del Consorcio de Implementación de Farmacogenómica Clínica (Clinical Pharmacogenomics Implementation Consortium Guideline, CPIC). La guía provee recomendaciones tales como prescribir dosis de TCA con base en el nivel de eficacia del metabolismo de TCA asociado con los genes CYP2D6 y CYP2C19. Los niveles de eficacia de la dosificación se dividen en los siguientes grupos: metabolizador ultrarrápido, metabolizador normal, metabolizador intermedio y metabolizador lento.
Las recomendaciones incluyen que los metabolizadores ultrarrápidos del CYP2D6 deben evitar el uso de TCA debido a que la rápida metabolización reduce la eficacia del medicamento. Si se necesita un TCA, deben tomar dosis mayores que las recomendadas para metabolizadores normales. Los metabolizadores normales deben iniciar la terapia con la dosis inicial recomendada, ya que su metabolización permite que el medicamento sea eficaz. Los metabolizadores intermedios deben comenzar con una reducción del 25 % de la dosis inicial recomendada. Estos pacientes tienen un metabolismo reducido que hace que los TCA estén menos activos; esto aumentaría la probabilidad de que el paciente experimente efectos adversos graves. Los metabolizadores deficientes deben evitar el uso de TCA y considerar el uso de un medicamento que no dependa de la metabolización del CYP2D6, pero si es necesario deben comenzar con una reducción del 50 % de la dosis inicial recomendada. Estos pacientes tienen un metabolismo reducido que no descompone completamente el medicamento; esto aumentaría la probabilidad de que el paciente experimente efectos adversos graves.
Las recomendaciones para los metabolizadores lentos y ultrarrápidos del CYP2C19 incluyen que deben evitar el uso de TCA. En cambio, deben usar medicamentos que no sean metabolizados por CYP2C19. Si es necesario, los pacientes deben utilizar la supervisión de medicamentos terapéuticos. Los metabolizadores deficientes deben comenzar con una reducción del 50 % de la dosis inicial recomendada. Los metabolizadores normales e intermedios deben iniciar el tratamiento con la dosis inicial recomendada.
B. Recomendaciones de dosificación con base en los resultados de la prueba NeuroIDgenetix
Los resultados de los investigadores Bradley et al. (2017) respaldaron aún más las conclusiones del estudio de Hicks et al. (2016). La tasa de remisión de la depresión de los pacientes del grupo experimental a las 8 semanas de seguimiento fue del 25 %, mientras que la tasa de remisión de la depresión del grupo de control fue del 9 %. En la consulta a las 12 semanas, la tasa de remisión del grupo experimental aumentó hasta el 35 %, mientras que la del grupo de control lo hizo hasta el 13 %. Las tasas de respuesta también fueron significativamente más altas para los pacientes del grupo experimental. En la consulta de seguimiento a las 8 semanas, la tasa de respuesta del grupo experimental en comparación con el grupo de control fue del 55 % versus el 28 % de los pacientes con diagnóstico de depresión grave. No hubo cambios significativos en los pacientes con diagnóstico de depresión leve. Se concluyó que estos pacientes puede que no se beneficien de los TCA.
En el caso de los pacientes con diagnóstico de ansiedad en el grupo experimental, sus tasas de respuesta aumentaron en un 63 %, mientras que en los grupos de control lo hicieron en un 50 %. Con base en las puntuaciones de la HAM-A, los clínicos notaron una reducción de los síntomas de ansiedad en los pacientes del grupo experimental. Para que las puntuaciones se contaran como significativas, los pacientes debían obtener una puntuación de 18 o menos. Las puntuaciones de HAM-A se redujeron en un 54 %.
La prueba NeuroIDgenetix aumentó las tasas de remisión de la depresión y la ansiedad de los pacientes del grupo experimental. Aunque las tasas de remisión de la depresión y la ansiedad de los pacientes del grupo de control también aumentaron, no fue tan significativo. Este estudio mostró que la genotipificación se puede utilizar como una herramienta de detección para reducir la gravedad de los efectos secundarios del medicamento.
Conclusión
El uso de la genotipificación como herramienta de detección puede reducir los efectos adversos graves de medicamentos como los antidepresivos. En el estudio realizado por Hicks et al. (2016) se han analizado los genes CYP2D6 y CYP2C19 de los pacientes mediante la genotipificación. También estudiaron cómo los genes se relacionan con la dosificación de TCA. Con base en el metabolismo de estos dos genes, se creó una guía que recomienda las dosis de antidepresivos. Los autores de este estudio han concluido que la farmacoterapia para los pacientes con CYP2D6 y CYP2C19 podría mejorar los resultados clínicos y reducir los efectos adversos.
El estudio realizado por Bradley et al. (2017) utilizó la prueba NeuroIDgenetix para ajustar la dosis de los medicamentos de los grupos experimentales con base en sus variantes genéticas CYP2D6 y CYP2C19. Tras los medicamentos sugeridos por la prueba NeuroIDgenetix, las tasas de remisión de la depresión y la ansiedad aumentaron significativamente según la prueba HAM-D y HAM-A. Los resultados del estudio corroboraron las conclusiones del estudio de Hicks et al.
Estos estudios han demostrado que las pruebas de farmacogenómica y la genotipificación pueden mitigar efectos adversos graves. En el futuro, la investigación también podría incluir el uso de la medicina de precisión para personalizar la medicina.
En el futuro, la investigación también podría incluir el uso de la medicina de precisión para personalizar la medicina.
Enlaces relacionados
- Bradley, P., Shiekh, M., Mehra, V., Vrbicky, K., Layle, S., Olson, M. C., … Lukowiak, A. A. (2017, September 23). Improved efficacy with targeted pharmacogenetic-guided treatment of patients with depression and anxiety: A randomized clinical trial demo... https://pubmed.ncbi.nlm.nih.gov/28992526/
- Hicks, J., Sangkuhl, K., Swen, J., Ellingrod, V., Müller, D., Shimoda, K., Bishop, J., Kharasch, E., Skaar, T., Gaedigk, A., Dunnenberger, H., Klein, T., Caudle, K. and Stingl, J. (2017), Clinical pharmacogenetics implementation consortium guideline... https://doi.org/10.1002/cpt.597
- Miller, John J. (2019, June 19). Psychiatric Pharmacogenomic Testing: The Evidence Base. Psychiatric Times. https://www.psychiatrictimes.com/view/psychiatric-pharmacogenomic-testing-evidence-base
- Psychiatric Pharmacogenomic Testing: The Evidence Base. Psychiatric Times. https://www.psychiatrictimes.com/view/psychiatric-pharmacogenomic-testing-evidence-base
- SD;, G. N. K. B. R. S. Human genome project: pharmacogenomics and drug development. Indian journal of experimental biology. https://pubmed.ncbi.nlm.nih.gov/11883519/
- U.S. Department of Health and Human Services. Pharmacogenomics. National Institute of General Medical Sciences. https://www.nigms.nih.gov/education/fact-sheets/Pages/pharmacogenomics.aspx
Acerca del autor
Jasmine Bonds está actualmente en el año sénior en la escuela secundaria Charles Herbert Flowers. Le interesa el tema de la farmacogenómica y el papel que desempeña en la práctica de la medicina de precisión.