Genómica: conocimiento

Una mirada a la creación de una vacuna contra la COVID-19
En diciembre de 2019, la COVID-19, una nueva enfermedad respiratoria, estalló en Wuhan, China, lo que resultó en una pandemia. Se necesita una vacuna, pero ¿qué implica la creación de una?
¿Qué es la COVID-19?
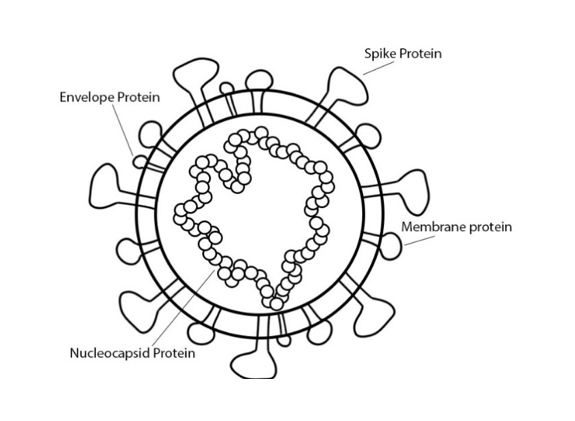
La COVID-19 es una enfermedad zoonótica causada por el virus SARS-CoV-2, que es un tipo de coronavirus con un tamaño de genoma de 30 kilobases. Las proteínas estructurales del virus incluyen la proteína espicular, de la membrana, de la envoltura y la nucleocápside. La replicación viral utiliza todas las proteínas estructurales y la infección del huésped implica la unión de la proteína espicular a la enzima convertidora de angiotensina II (angiotensin-converting enzyme II, ACEII) (Ahmed).
¿Cómo actúan las vacunas?
Las vacunas utilizan el antígeno objetivo, la estructura molecular que provoca una respuesta de anticuerpos, para crear inmunidad específica de antígeno. Las vacunas pueden ser atenuadas en vivo (una forma debilitada del antígeno), inactivadas (una forma inactiva del antígeno) o una subunidad (una parte del antígeno). El uso de una vacuna viva atenuada proporciona fácilmente una fuerte inmunidad, pero no se puede administrar en sistemas inmunitarios débiles, ya que el antígeno sigue siendo dañino. De manera alternativa, se puede administrar una vacuna inactivada a sistemas inmunitarios débiles porque no puede causar enfermedades, pero es menos potente y, por lo general, requiere muchas dosis para lograr la inmunidad. El uso de solo una parte del antígeno, como una proteína viral, crea una vacuna que puede inducir inmunidad después de dos dosis sin dejar de ser lo suficientemente segura para los sistemas inmunitarios más débiles. Pero las vacunas de subunidades, a menudo, requieren un adyuvante para estimular la respuesta inmunitaria al antígeno. Además, gracias a las modernas técnicas de edición de genes, los científicos pueden crear vacunas que utilizan material genético. La vacuna recombinante es uno de esos ejemplos. Inserta el material genético del antígeno en un vector para que los genes puedan expresarse a partir del vector y purificarse. La proteína resultante se usa en la vacuna. Las vacunas de ADN y ARN también utilizan material genético. Estas vacunas inyectan directamente el ADN o ARN del antígeno en el receptor, de modo que las células del receptor puedan expresar los genes (“Vaccine Types”). Sin embargo, el material genético debe estar encapsulado en un vector, ya que el ADN y el ARN en bruto se degradan en los fluidos biológicos (Cullis and Hope).
"Las vacunas utilizan el antígeno objetivo para crear inmunidad específica de antígeno".
¿Dónde empezamos?
Desafortunadamente, no se sabe mucho sobre el SARS-CoV-2, por lo que la elaboración de vacunas es difícil. Pero el virus que causa el SARS, el SARS-CoV, es genéticamente similar al SARS-CoV-2. Como consecuencia, la información inmunitaria sobre el SARS se puede utilizar en la investigación de la vacuna contra la COVID-19 (Ahmed).
Por ejemplo, se puede observar la importancia de las proteínas espiculares y nucleocápside. Las proteínas espiculares forman la membrana más externa del virus, y las proteínas de nucleocápside forman la cápside, o la carcasa, alrededor del material genético viral. La selección de proteínas espiculares en las vacunas contra el SARS ha provocado fuertes respuestas inmunitarias, probablemente debido a la función que desempeñan las proteínas espiculares en la unión del virus al huésped. Dirigirse a las proteínas nucleocápside también provocó fuertes respuestas inmunitarias, lo que es un buen augurio porque la proteína es abundante durante la infección. Estas dos proteínas sirven como un buen punto de partida para la investigación de la vacuna contra la COVID-19 (Ahmed).
Las funciones de las respuestas inmunitarias humorales (células B) y mediadas por células (células T) en el caso del SARS también son reveladoras. En el SARS, las respuestas inmunitarias mediadas por células parecen ser las más poderosas, especialmente aquellas que se dirigen a las proteínas nucleocápside y espicular. Varios de estos epítopos de células T del SARS-CoV también están presentes en el SARS-CoV-2. Las respuestas inmunitarias humorales también podrían ser potencialmente interesantes: las respuestas de las células B del SARS-CoV contra las proteínas espiculares en ratones fueron capaces de proteger contra el SARS, y muchos epítopos de células B del SARS-CoV se mapean perfectamente en el SARS-CoV-2. Hay respuestas exitosas de las células B del SARS que se dirigen a la proteína nucleocápside, pero la inmunidad no dura mucho (Ahmed).
¿Cuáles son algunas de las opciones de vacunas en este momento y cómo actúan?
A partir del 8 de abril, cinco posibles vacunas comenzaron ensayos clínicos, y todas de alguna manera utilizan la genómica (Le).
Una vacuna la fabricó ModernaTX Inc. y se llama mRNA-1273. Es una vacuna de ARNm que codifica una proteína espicular del SARS-CoV-2 (“Safety and Immunogenicity Study of 2019-nCoV Vaccine” [Estudio de seguridad e inmunogenicidad de la vacuna 2019-nCoV]). El ARNm está encapsulado para inyectar en una nanopartícula lipídica (lipid nanoparticle, LNP), que es un vector no viral que tiene un tamaño de 100 nanómetros o menos y puede mantener la estabilidad durante al menos un año a 4 grados C (Cullis and Michael)./p>
"A partir del 8 de abril, cinco posibles vacunas comenzaron ensayos clínicos, y todas utilizan la genómica".
Cansino Biologics Inc. también está investigando su propia vacuna contra la COVID-19, llamada Ad5-nCoV. Se trata de una vacuna recombinante que expresa la proteína espicular, como la vacuna anterior. Esta vacuna utiliza un vector de adenovirus tipo 5 para el material genético (“Phase 1 Clinical Trial of a COVID-19 Vaccine” [Ensayo clínico de fase 1 de una vacuna contra la COVID-19]). Un adenovirus es un virus que es un potente vector viral debido a sus altas propiedades inmunogénicas y su genoma grande y fácil de editar (alrededor de 36 kilobases) (Zhang and Zhou).
Otra posible vacuna es la INO-4800, de Inovio Pharmaceuticals. Es una vacuna de plásmido de ADN que también codifica la proteína espicular (“Safety, Tolerability, and Immunogenicity of INO-4800” [Seguridad, Tolerabilidad e Inmunogenicidad de INO-4800]). Un plásmido de ADN es una molécula de ADN circular no cromosómica que se utiliza en las vacunas de ADN como vector del material genético (“DNA Vaccines” [Vacunas de ADN]). Esta vacuna utiliza la electroporación, que es un método de administración de vacuna genética que implica el uso de un pulso de electricidad para abrir los poros de la membrana celular, lo que hace que la administración de la vacuna sea más eficiente (Sardesai and Weiner).
LV-SMENP-DC es otra vacuna desarrollada por Shenzhen Geno-Immune Medical Institute. Utiliza células dendríticas, que son células presentadoras de antígenos. Estas células dendríticas se modifican con vectores lentivirales para expresar un minigén artificial para proteínas seleccionadas del SARS-CoV-2 (“Immunity and Safety of Covid-19 Sythetic Minigene Vaccine” [Inmunidad y seguridad de la vacuna minigénica sintética contra la COVID-19]). Un lentivirus es un virus de ARN que puede transducir células no divisorias y divisorias, lo que significa que puede insertar material genético extraño en otras células (Li and Rossi).
El Shenzhen Geno-Immune Medical Institute también está probando una vacuna llamada aAPC específica de patógenos (“Safety and Immunity of Covid-19 aAPC Vaccine” [Seguridad e inmunidad de la vacuna contra la COVID-19 aAPC]). La tecnología aAPC implica la creación de células presentadoras de antígenos artificiales mediante la unión de dos o tres señales a un vector que desencadena las respuestas de las células T (Neal). Estas señales incluyen el complejo principal de histocompatibilidad y las proteínas CD80 y CD86. Las aAPC de esta vacuna se modifican con un vector lentiviral para expresar un minigén artificial para determinadas proteínas del SARS-CoV-2 (“Safety and Immunity of Covid-19 aAPC Vaccine”).
¿Cuándo se elaborará una vacuna?
A la elaboración de una vacuna para combatir el coronavirus todavía le faltan de 12 a 18 meses aproximadamente. Si bien la mayoría de las vacunas tardan una década o más en aprobarse, los científicos están trabajando para desarrollar un calendario de pruebas que permita que el proceso sea más rápido y, al mismo tiempo, garantice que la vacuna sea segura y eficaz. El ensayo clínico en el que los científicos están trabajando para demostrar las vacunas tiene cuatro fases. La fase 1 estará conformada por un pequeño grupo de personas sanas y se centrará en la seguridad de la vacuna y en la observación de las respuestas inmunitarias que provoca a diferentes dosis. En la fase 2, cientos de personas participarán en un estudio aleatorio, doble ciego y controlado con placebo en el que los científicos evaluarán la seguridad y la eficiencia, determinarán la dosis óptima y generarán el programa de vacunación ideal. La siguiente parte del ensayo clínico es la revisión regulativa, donde la organización a cargo de aprobar nuevas vacunas revisará la información recopilada del ensayo. La fase final incluye estudios posteriores a la aprobación que supervisan la efectividad de la vacuna en condiciones del mundo real (Prichep).
“A la elaboración de una vacuna para combatir el coronavirus todavía le faltan de 12 a 18 meses aproximadamente”.
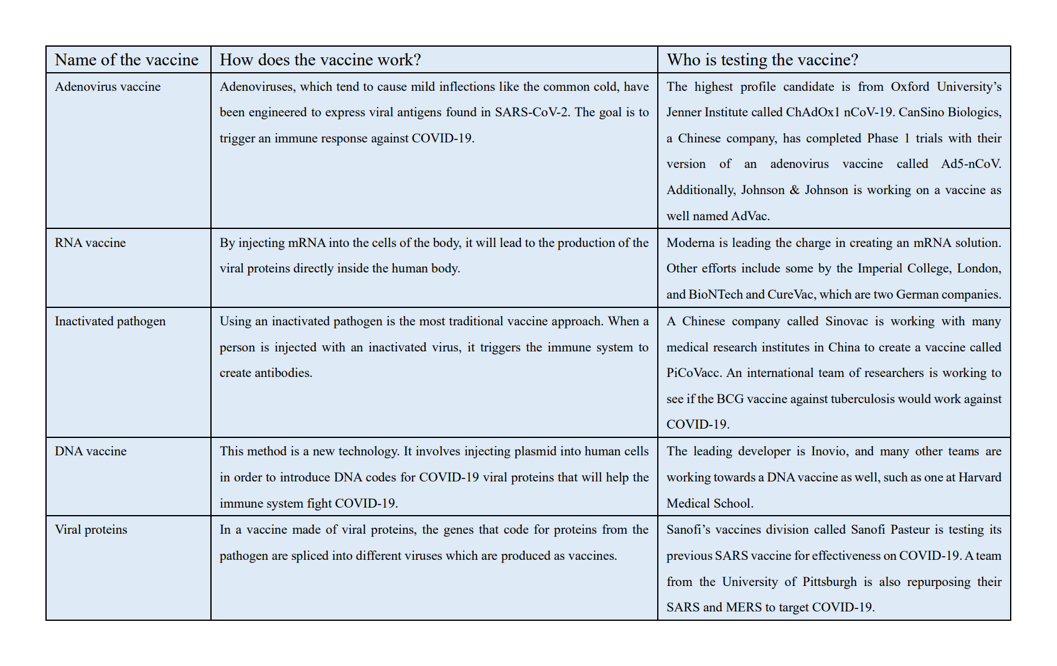 Figura 2: Los 5 candidatos a la vacuna contra la COVID-19 más prometedores, a partir del 1.º de junio (Lynas)
Figura 2: Los 5 candidatos a la vacuna contra la COVID-19 más prometedores, a partir del 1.º de junio (Lynas)Una gran preocupación en el campo de la medicina es que, con 100 tratamientos y vacunas que se intentan crear al mismo tiempo, estamos perdiendo tiempo y recursos (Jasarevic). Para resolver este problema, el 17 de abril, los Institutos Nacionales de Salud anunciaron un plan para organizar ensayos clínicos para los fármacos y vacunas que son las más altas prioridades para las pruebas y el desarrollo. Esta iniciativa, llamada Aceleración de Intervenciones Terapéuticas y Vacunas contra la COVID-19 (Acceleration COVID-19 Therapeutic Interventions and Vaccines, ACTIV), incluye a los Institutos Nacionales de Salud (National Institutes of Health, NIH), otras agencias gubernamentales de EE. UU., 16 compañías farmacéuticas y biotecnológicas y la Fundación para las Instituciones Nacionales de Salud. La meta es aprovechar al máximo los recursos de los que dispone el NIH al trabajar con las compañías para evaluar los datos sobre las primeras vacunas candidatas y llevar las más prometedoras al proceso clínico cuidadosamente diseñado por los NIH. Los mejores candidatos tendrán prioridad para recibir el fondo de $1,800 millones que el Congreso otorgó a los NIH para la investigación de la COVID-19, así como el acceso a la red de ensayos clínicos de los NIH (Kaiser).
¿Qué se debe hacer para que la vacunación sea masiva?
Incluso si se crea y aprueba una vacuna dentro de 12 a 18 meses, los investigadores advierten que tal vez no sea posible que la vacuna esté disponible para todos. Es un desafío hacer que las vacunas lleguen a todos los que las necesitan, ya que todos los países tendrán que competir por el mismo medicamento. Dado que las pandemias tienden a ser más graves en los países con sistemas de salud frágiles y fondos insuficientes, existe una lucha constante entre la necesidad y el poder adquisitivo cuando se trata de medicamentos. Por ejemplo, en la pandemia de gripe H1N1 en 2009 las vacunas fueron adquiridas por los países que podían pagarlas, y la mayoría de los países en desarrollo que necesitaban las vacunas tanto o más no pudieron comprarlas. A los expertos también les preocupa que los principales proveedores de vacunas, como India, puedan utilizar su producción para ayudar a sus 1,300 millones de habitantes antes de exportarla a otros países que no tienen la capacidad de producir vacunas a la misma escala. Además, los recursos necesarios para fabricar la vacuna contra la COVID-19 deberán equilibrarse con la necesidad de otras vacunas cruciales, como la vacuna contra la influenza que se fabrica en cientos de millones de dosis cada año (Khamsi).
"...es un desafío hacer que las vacunas lleguen a todos los que las necesitan, ya que todos los países tendrán que competir por el mismo medicamento".
Acerca del autor
Calla O’Neil es una estudiante de segundo año de secundaria de 16 años que asiste a Whittle School and Studios en Washington D. C. Le interesa el asunto de las pandemias globales y la colaboración internacional y estaba interesada en combinar estos temas con su pasión por escribir al ser coautora de este artículo.
Ella Song también es una estudiante de segundo año de 16 años en Whittle School and Studios en Washington D. C. Tiene interés en la genética y la patología, lo cual la motivó a explorar para este artículo.